نویسنده:محمد مهدی کرد
بی شک مهم ترین بهره ای که از علوم تجربی خاصه ی شیمی نصیب انسان می شود این است که انسان با این ابزار به خوبی می تواند از منابع و امکانات طبیعی به نفع خود برای بهبود زندگی استفاده کند.پیشرفت های تکنولوژیکی در همه ی زمینه های صنعتی ،کشاورزی،پزشکی، ساختمان و…همه به سبب پیشرفت های علمی در به کارگیری از مواهب طبیعی در جهت اهداف زندگی بشر بوده است.
همه ی موادی که مورد مصرف ما است به طور مستقیم و غیرمستقیم از زمین به دست می آید.برخی از آنها مانند زغال سنگ ونمک و پنبه و چوب و پشم به طور طبیعی و خام در طبیعت وجود دارد و همان طور که به دست می آیدمصرف می کنیم.اما بیشتر مواد مورد نیاز بشری به صورت آماده در طبیعت وجود ندارند، آنها یا به صورت ترکیب با مواد دیگر و یا به صورت مخلوط است و یا حتی باید آنها را به شکل مصنوعی ساخت .مثلا آهن و اکثر فلزات به صورت ترکیب با عناصر دیگر است و برای به دست آوردن آنها باید از واکنش های شیمیایی خاص خود استفاده کرد،ویا نفت مخلوطی از چندین ماده مهم و ضروری است که باید آنها را از هم جدا کرد،یا برای تهیه انواع رنگ و پلاستیک و دارو و شوینده ها و ... باید به صورت مصنوعی و با استفاده از واکنش های شیمیایی معینی آنها را ساخت.
برای تهیه هر نوع ماده اولیه روش و روش های خاصی وجود دارد، به کلیه روش هایی که طی آن یک ماده را از مخلوط آن جدا می کنند روش های جداسازی گویند.
هر مخلوط شامل دو یا جند نوع ملکول است که بدون تاثیر خاصی کنار هم قرار دارند،از آنجا که هر نوع ملکول خواص مخصوص به خود را داردبا توجه به اختلاف خواص آنها می توان آنها را از هم جدا کرد. اختلافاتی مانند: اختلاف در قابلیت حل شدن،اختلاف درچگالی،اختلاف در نقطه جوش، اختلاف در خاصیت مغناطیسی،اختلاف در نفوذ گازها و .....
مهمترین روش های جدا سازی مواد در آزمایشگاه عبارتند از: تقطیر، تبلور، استخراج ، تصعید ، کروماتوگرافی.
پرسش:
1- به نظر شما در بازیافت زباله ها چگونه قطعات فلزی را از هم جدا می کنند؟
2- با استفاده از چه خاصیتی خامه را از شیر جدا می کنند؟
v تقطیر
یکی از روش های اساسی برای جدا سازی مایعات فرار در آزمایشگاه تقطیر است. در این روش محلول ( ماده ناخالص ) با حرارت تبخیر شده و پس از سرد و متراکم شدن از هم جدا می شوند.برای تقطیر روش های متفاوتی وجود دارد که انتخاب هر روش به خواص مایع تقطیر شونده و ناخالصی های موجود در آن دارد.برخی از تکنیک های تقطیر عبارت است از:
تقطیر ساده، تقطیر جزء به جزء، تقطیر در فشار کم، تفطیر با بخار آب، تقطیر در مسیر کوتاه.
اساس عمل تقطیر بر این پایه استوار است که مواد مخلوط شده با هم به علت اختلاف نقطه ی جوش در حالت مایع و بخار درصد متفاوتی پیدا می کنند. مثلا" اگر دو مایع A و B که اختلاف جوش دارند و نقطه ی جوش A بیشتر از B است به نسبت 40 درصد A و 60 درصد B با هم ممزوج شوند و آنها را تبخیر کنیم درصد آنها در حالت بخار با درصد آنها در مایع فرق خواهد کرد.مثلا" به صورت 20 درصد A و80 درصد B می شود که اگر آنها را سردکنیم مخلوطی به دست می آید که نسبت به مخلوط اولیه خالص تر است و اگر این عمل را مرتبا" تکرار کنیم خالص تر شده در نهایت ماده خالص به دست می آید.وجود ناخالصی ها دریک مایع نقطه ی جوش را بالا می برد. لذا قبل از آن که محلول به جوش آید اجزاء فرار آن زود تر تبخیر شده و درصد آن جزء در بخار بالای محلول بیشتر می شود.
v تقطیر ساده
معمولا" اگر دو ماده ای که با هم ممزوج شده اند اختلاف فشار بخار زیادی داشته باشند از این روش می توان برای جدا سازی آنها استفاده کرد . مانند خالص سازی آب و نمک.
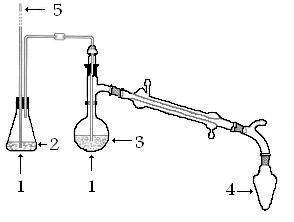 شکل 1
شکل 1
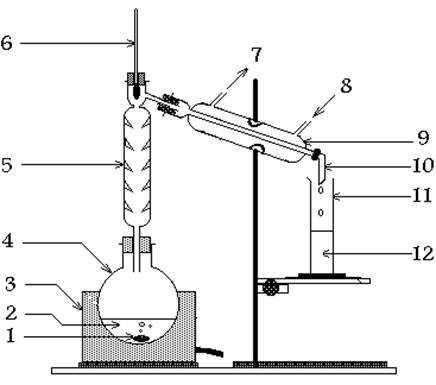
روش کار: درآزمایشگاه برای تقطیر ساده از دستگاهی مطابق شکل (1)استفاده می شود. ماده ی تقطیر شدنی را در بالن ریخته تا حدود3/1 آن پر شود مقدار زیاد تر بازده عمل راکاهش می دهد. به آنچه که پس از عمل تقطیر در ته بالن باقی می ماند ته دیگ می گویند. لازم به ذکر است که در ضمن عمل تقطیر مرتبا" به غلظت محلول اضافه می شود. معمولا" وقتی مایعی را بدون بهم زدن حرارت می دهیم در بخشی از داخل مایع حرارت به حدی زیاد می شود که دمای آن از نقطه ی جوش بالا تر رفته ولی مایع نمی جوشد. در این حالت اصطلاحا" می گوییم که در نقطه ی جوش تاخیر صورت گرفته است. برای پیشگیری از این تاخیر می توان از چند عدد سنگ ریزه ی خشک استفاده کرد و آنها را در بالن انداخت. به این سنگ ریزه ها سنگ جوش می گویند.
پرسش:سنگ جوش چگونه از تاخیر در نقطه ی جوش پیشگیری می کند؟
بخــاراتـی که ازبـالـن تقطیر متـصاعد می شـود در حیـن عبور ازمبرد به تدریج سرد و متـراکم شده و به مایع تبدیل می شـود. به این مایع مقطره می گویند. لوله ی مبرد دارای دو جدار داخلی وخارجی است. جدار داخلی آن معمولا" مارپیچ بوده و بخارات ضمن عبور از آن سرد و متراکم شده و مایع می شود.جدار خارجی آن به صورت غلافی روی دیواره ی داخلی را پوشانده است و دارای دو مجرای ورودی و خروجی آب سرد می باشد. آب از پایین وارد و از بالا خارج می شود. پس از جوش آمدن محلول دمای شعله را طوری تنظیم می کنیم که در هر ثانیه حد اکثر یک قطره خارج شود.
پرسش: چرا آب سرد از لوله ی پایینی وارد می شود؟
v تقطیر جزء به جزء
اگر موادی که با هم ممزوج شده اند نقطه ی جوش نزدیکی داشته باشند و یا شامل چند نوع مایع مختلف باشد معمولا" از تقطیر جزء به جزء استفاده می شود. در این روش مبرد به صورت عمودی روی بالن قرار می گیرد و بخارات ضمن صعود به ترتیب نقطه ی جوش تفکیک می شود. مایعاتی که نقطه ی جوش پایینی دارند ابتدا از مبرد خارج می شوند. در این روش تنظیم دمای شعله و دمای بخاراتی که متصاعد می شود بسیار مهم است. معمولا" مقطرات فواصل دمایی مختلف را جمع آوری کرده و سپس آنها را مجددا" تقطیر می کنند یا پس از هر مرحله مایع خالص تر به دست می آید.
v تبلور مجدد می دانیم که محلول های مایع شامل حلال مایع و یک یا چند ماده حل شدنی است. مثلا" محلول کات کبود شامل آب (حلال) و کات کبود CuSO4 (ماده ی حل شدنی) است. معمولا" مواد حل شدنی جامد به هر مقدار دلخواه در حلال مناسب خود حل نمی شوند و پس از حل شدن مقدار ی از آن محلول سیر شده یا اشباع به وجود می آورند. برای یک ماده ی حل شدنی خاص، مقداری که بتواند در یک دمای معینی در 100 گرم حلال حل شود مقدار ثابتی است که به آن قابلیت حل شدن آن ماده گویند. به عبارت دیگر قابلیت انحلال یک ماده ی جامد عبارت است از: مقدار آن ماده بر حسب گرم که در یک دمای معینی (معمولا" 25 درجه) در 100 گرم حلال (معمولا" آب) حل شده و محلول سیر شده بسازد. مثلا" قابلیت انحلال نیترات پتاسیم (KNO3 ) در º20 ، برابر 25 گرم است یعنی در دمای º20 ، 25 گرم نیترات پتاسیم (KNO3 ) در 100 گرم آب (حلال) حل شده و محلول سیر شده می سازد. بدیهی است که مواد مختلف قابلیت انحلال متفاوتی دارند بیشتر جامدات در حلال گرم نسبت به حلال سرد قابلیت بیشتری دارند. یعنی افزایش دما اغلب سبب افزایش قابلیت انحلال می شود. پرسش: 1-قابلیت حل شدن کلرات پتاسیم (KClO3 ) درº 80 برابر 200 گرم و در º30، برابر 120 گرم است. اگر 450 گرم محلول اشباع º80 را تا º30 سرد کنیم چند گرم کلرات سدیم (NaClO2 ) رسوب می کند؟ 2-10 گرم نمک طعام را در دمای º10 در 50 گرم آب محلول سیر شده تولید می کند. الف) وزن محلول چقدر است؟ ب) قابلیت حل شدن نمک طعام در این دما چند گرم است؟ اگر اجزاء یک مخلوط قابلیت حل شدن یکسانی نداشته باشند و قابلیت آنها با دما یکسان تغییر نکند و یا جزء ناخالص مخلوط کم باشد با استفاده از روش ((تبلور مجدد)) می توان ماده ی خالص را از مخلوط (ناخالصی ها) جدا کرد. در ایـن روش جسم نـاخـالـص را ابتــدا در حلال مناسـب (معمولا" آب) حل کرده و حرارت می دهند تا محلول اشباع داغ تولید شود. محلول حلال + جامد سپس محلول داغ را به تدریج سرد می کنند. وقتی که محلول سرد می شود مواد حل شده در آن متناسب با کاهش قابلیت انحلال به صورت بلور در می آیند. اگر کاهش قابلیت انحلال ماده ی خالص شدنی بیشتر از سایر ناخـالصی ها باشد و یا میزان ناخالصی ها کم باشد با کـاهش تـدریجی دما ماده ی خالص به صورت بلورهای منظم در ظرف تشکیل می شوند و ناخالصی ها در محلول باقی می ماند. اگر محلول اشباع داغ سریعا" سرد شود ناخالصی ها نیز رسوب کرده و باعث کاهش بازده عمل می شود.ولی اگر محلول به آرامی سرد شود ابتدا بلور کوچکی از ماده خالص تشکیل می شود ودر صورتی که در دمای پایینتر دما تقریبا ثابت بماند با ایجاد تعادل بین محلول و بلور به تدریج بلور رشد کرده و متناسب با شکل ملکول رشد می کند. زمان لازم برای تبلور مجدد بشتگی به نوع حلال ، ناخالصیهای آن و نوع ماده ماده خالص شدنی داشته و بین 10 دقیقه تا 24 ساعت متغیر است.گاهی در صورتی که ناخالصی یک مخلوط کم باشد می توان از این روش استفاده کرد. مثلا می خواهیم مخلوطی که شامل 4 گرم ماده A و 1 گرم ماده B را از هم جدا کنیم . فرض کنیم که قابلبت انحلال هر دو در حلال داغ 5 گرم( در 100 گرم حلال ) و در حلال سرد 1 گرم (در 100 گرم حلال ) باشدبنا بر این اگر مخلوط را در 100 گرم حلال حرارت دهیم تمامی مخلوط حل می شود پس از سرد کردن ؛ 3 گرم ماده A متبلور خواهد شد و یک گرم ماده B در محلول باقی خواهد ماند.چرا؟ گاهی لازم است که فرایند تبلور را چند بار تکرار کرد تا تمامی خالصی حذف گردد. پرسش: تحقیق کنید که چگونه می توان شکر را از مخلوط "شکر و نمک" جدا کرد؟ آزمایش: با استفاده از روش تبلور مجدد درجه خلوص مقداری از کات کبود ناخالص نمونه آزمایشگاهی را تعیین کنید. v استخراج استخراج یعنی انتقال یک ماده حل شده از یک فاز به فاز دیگر؛ فاز ترکیب یا محلولی است که همه خصوصیات فیزیکی و شیمیایی در سرتاسر آن یکسان بوده و به طور آشکارا از ترکیب ویا محلول دیگر قابل تمیز باشد. مثلا آب نمک و نفت شامل دو فاز مایع است ( یکی فاز نفت و دیگری فازمحلول نمک) و یا مخلوط فوق اشباع آب قند شامل دو فاز است( یکی فاز مایع آب قند و دیگری فاز جامد قند ته نشین شده)ویا آب یخ شامل دو فازاست( یکی آب مایع و دیگری فاز جامد یخ). در عمل استخراج ماده حل شده در یک فاز با اضافه شدن حلال مناسب و غیر قابل اختلاط با فاز اول وارد فاز دوم می شود ( حلال جدید) و از مخلوط اولیه جدا می شود؛ به شرط اینکه قابلیت انحلال ماده حل شده در فاز دوم بیشتر از فاز اول باشد. اگر ماده ای از فاز جامد به داخل فاز مایع استخراج شود ، استخراج را جامد – مایع می گوییم؛مانند تهیه چای.در این مثال ماده حل شده (ماده رنگین چای) در داخل برگ چای محلول است(فاز جامد) پس از ریختن آب جوش چون قابلیت انحلال این ماده در آب بیشتر است وارد آب جوش شده و محلول رنگی می سازد.( فاز مایع) پرسش: چرا برای تهیه قهوه دانه قهوه را آسیا می کنند؟ انتقال یک جسم از فاز مایع به مایع دیگر را استخراج مایع – مایع گویند. حذف ید از آب به وسیله تتراکلرید کربن نمونه ای از استخراج مایع – مایع است. ید به مقدار کم در آب حل می شود ولی قابلیت انحلال آن در تتراکلرید کربن بسیار بیشتر است در حالی که آب و تتراکلرید کربن قابل اختلاط نیستند. وقتی تتراکلرید کربن به مخلوط آب و ید اضافه می کنیم پس از به هم زدن درصد زیادی از ید حل شده وارد فاز تتراکلرید کربن می شود. نسبت غلظت ماده حل شده در فاز استخراج کننده به غلظت ماده حل شده در فاز اولیه را ضریب توزیع(KD)گویند. غلظت همان ماده در فاز اولیه/ غلظت ماده حل شده در فاز استخراج کننده = KD هرچه ضریب توزیع یک ماده در حلال فاز استخراج کننده بیشتر باشد بازده عمل بیشتر است. مثلا اگر ضریب توزیع ماده A بین حلال های اتر و آب 4 باشد ( KD=4) غلظت A در حلال اتر 4 برابر غلظت آن در آب خواهد بود. در این صورت اگر50 mml اتر را در 50mml محلول آبی 40 mg/ml ماده A بریزیم ؛ وزنی از ماده A که وارد فاز اتر می شود برابر است با : X mg/50 KD= = 4 4(40-x)=4 160=5x x=32 mg (40 – x)mg/50ml با ادامه عمل استخراج می توان8ml با قیمانده ماده A را از محلول آبی آن جدا کرد. استخراج ها روش نسبتا ساده ای هستند و بسیار مورد استفاده قرار می گیرند و برای خالص سازی بسیاری از ترکیبات حاصل از واکنش های شیمیایی و استخراج الکالوییدها از برگ ویا پوست گیاهان و استخراج اسانس های مواد غذایی از دانه ها و گل ها ویا استخراج شکر از نیشکر و ... استفاده می شود. در آزمایشگاه ساده ترین وسیله که برای استخراج استفاده می شود قیف جدا کننده (دکانتور) است. روش کار:ابتدا محلولی را که باید مورد استخراج قرار گیرد در دکانتور می ریزیم، سپس حلال فاز دوم را اضافه می کنیم؛ حجم کل مخلوط نباید از حدود 3/2 حجم کل قیف بیشتر باشد درغیر این صورت جایی برای مخلوط کردن آنهاوجود نخواهد داشت. در پوش را مرطوب کرده روی قیف می گذاریم سپس قیف را طوری در دست می گیریم که یک دست روی شیر و لوله، و دست دیگر روی در پوش و بدنه قیف قرارگیرد. با حرکت دادن قیف به صورت چرخشی 30 تا 60 ثانیه مایعات را به خوبی مخلوط می کنیم. در طول این عمل با باز و بسته کردن شیر و یا در پوش فشار داخل قیف را تنظیم می کنیم، خصوصا موقعی که از مخلوط کردن مایعات گاز تولید می شود. پش از مخلوط کردن، قیف را مستقیم و عمودی نگه می داریم و آن را به آرامی می چرخانیم به طوری که محلول داخل آن حرکت چرخشی انجام دهد با این عمل فازها به آرامی از هم جدا می شوند و از ایجاد امولیسین حتی الامکان پیش گیری می شود. بعد از آنکه فازها از هم جدا شدند درب قیف را برداشته و مایع زیری را تخلیه می کنیم. v کرو ماتوگرافی کروماتوگرافی برای اولین بار در سال 1906 توسط یک گیاه شناس روسی به نام میشل توت کشف و نام گذاری شد. او سعی داشت که رنگدانه های برگ های رنگی را به وسیله ی عبور دادن محلول عصاره ی برگ ها از یک ستون پر شده از گچ از یکدیگر جدا کند. هر رنگدانه با سرعت متفاوتی به طرف پایین ستون حرکت کرده و از هم جدا می شود و از اجزای جدا شده در طول ستون به صورت نوارهای رنگین قابل تشخیص بود. به این روش جدا سازی کروما (رنگ) + گرافی (نوشتن) گویند. امروزه از کروماتوگرافی برای جداسازی و شناسایی بسیاری از مخلوط ها با خواص مختلف و در حجم های کم استفاده می شود و متناسب با خواص فیزیکی و شیمیایی که اجزای مخلوط دارند روش های متفاوتی برای کروماتوگرافی ابداع شده است مانند: کروماتوگرافی کاغذی(PC) – کروماتوگرافی ستونی – کروماتوگرافی لایه نازک (TLC)- کروماتوگرافی گازی(GC) . دستگاه کروماتوگرافی شامل دو فاز ساکن و متحرک است. برای نشان دادن اصول اساسی کروماتوگرافی جداسازی یک نمونه مخلوط ،شامل سه جزء است را در یک ستون در نظر بگیرید؛ فاز ساکن شامل ذرات متخلخل جامد(مانند گچ)است که در یک لوله باریک و بلند شیشه ای به نام ستون انباشته شده است. حجم کمی از نمونه را به داخل ستون تزریق می کنیم و حلال که فاز متحرک است را روی آن می ریزیم.حلال در ستون حرکت می کند و نمونه را با خود در طول ستون حرکت می دهد؛ هر یک از اجزای مخلوط متناسب با ضریب توزیع مخصوصی که دارد(KD) به روی فاز ساکن به طور متفاوتی دچار جذب و واجذب می شوند. اختلاف سرعت های نسبی حرکت اجزاء در طول ستون موجب می گردد که اجزا از هم جدا شوند
نویسنده:محمد مهدی کرد
 شکل 1
شکل 1


 واکنش های شیمی و شیوه نمایش ان
واکنش های شیمی و شیوه نمایش ان